Tip van de maand
nuttige wenken en praktische tips voor de mineralenverzamelaarvoor vragen of suggesties, email tips@minerant.org
Tip 8: microchemie deel 3; magnesium aantonen
een tip van Paul Mestrom2.jpg)
Op de IRMM 2015 (ruilbeurs voor micromounters van GEA-kring Limburg) zag ik stukjes met als label “hydromagnesite, In den Dellen, Eifel, Germany”. De kristalletjes waren klein maar mooi en daarom ruilde ik drie exemplaren van dit materiaal. Onderstaande foto (gemaakt door “stacking” van een selectie van 17 van 50 gemaakte foto’s) toont de kristalletjes. In de diepte is een roodbruine bol van magnesiet met sideriet te zien. De beeldbreedte is 7 mm, het grootste kristal 0,5 mm.

Thuis gekomen kon ik noch op internet noch in mijn literatuur “In den Dellen” als vindplaats van hydromagnesiet vinden. Ik kreeg hierdoor twijfels over de juistheid van het label en besloot daarom het mineraal microchemisch te onderzoeken. Voor het onderzoek brak ik een paar “brokken” van elk ongeveer 0,25 mm af. Met de houder van tip 3 werden de reacties in druppels reagentia door de microscoop gevolgd en gefotografeerd. Door de snelheid van handelen is de kwaliteit van de foto’s in sommige gevallen niet geweldig.
Hydromagnesiet is Mg5(CO3)4(OH)2·4H2O, een carbonaat dus met Mg2+.
Die magnesium-ionen zijn aan te tonen met de volgende werkwijze:
- los het mineraal (zie rode pijl) op in zoutzuur door een “brok” mineraal voorzichtig in die druppel te schuiven met een naaldje of iets dergelijks. In dit geval ging dat oplossen vlot met levendig bruisen (de OH- -ionen en het kristalwater maken het rooster veel zwakker dan dat van magnesiet, MgCO3, dat veel moeilijker oplost).
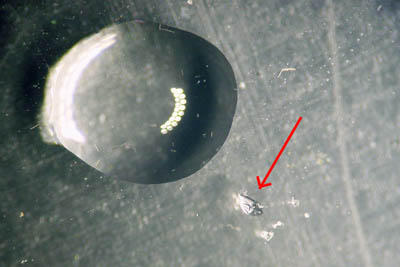
Vóór reactie (de rode pijl wijst naar een 0,25 mm brok van het mineraal naast de druppel 3% zoutzuur):
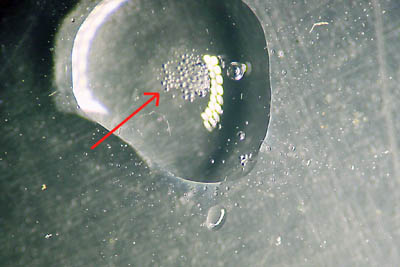
Tijdens de reactie (de pijl wijst naar de gasbelletjes die ontstonden):
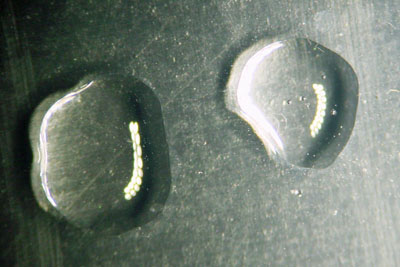
- leg er na de reactie een druppel geconcentreerde oplossing van NaOH (natronloog) naast:
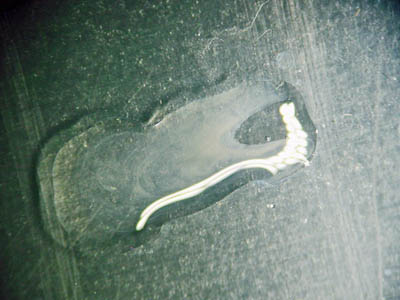
- Verbind de beide druppels (met een dun staafje van bv glas of plastic). Bij aanwezigheid van magnesium-ionen ontstaat een wit neerslag (troebeling) van magnesiumhydroxide ( Mg(OH)2 ):
- Los een klein beetje titaangeel op in een druppel water (door het titaangeel met
een dun plastic staafje in de druppel te schuiven en te “roeren”).
Foto 1 toont het donkerbruine titaangeel naast een druppel water; rechtsboven is de oplossing met het (vermoedelijke) magnesiumhydroxide zichtbaar:

Foto 2: na het “roeren”: de oplossing van het (in oplossing gele) titaangeel:

- Verbind de oplossing van titaangeel met de oplossing met het (vermoedelijke) magnesiumhydroxide. Als er inderdaad Mg(OH)2 aanwezig is kleurt dit rood. Dat is te zien op de foto bovenaan deze tip.
Het onderzochte mineraal was dus zeker een magnesiumhoudend carbonaat, hoogst waarschijnlijk hydromagnesiet, zoals het label al vermeldde.
Nota's
- De NaOH-oplossing werd gemaakt door in een micromountdoosje (24 mm) een
“pellet” NaOH in een paar druppels water te brengen:

- In plaats van NaOH kan ook KOH gebruikt worden
- Als er behalve magnesiumionen ook nog andere metaalionen aanwezig zijn kan dat
het resultaat negatief beïnvloeden. In zo’n geval is een veel lastiger werkwijze met
grotere hoeveelheden materiaal noodzakelijk.
- Ca2+ stoort bij deze werkwijze niet, want ik heb de methode al vaak gebruikt voor het onderscheid calciet-dolomiet.
Mn2+ en U6+ (in UO22+) storen wel, ze geven ook een rode kleur (volgens het boekje van Annelore Köster-Pflugmacher).
Veel Fe3+ stoort door de kleur van het ijzer(III)hydroxide dat kan ontstaan.
- De reactie met titaangeel is een complexvorming, wat logisch is als je naar de structuurformule van titaangeel kijkt.
Zie Wikipedia en Chemical Book.
