Tip van de maand
nuttige wenken en praktische tips voor de mineralenverzamelaarvoor vragen of suggesties, email tips@minerant.org
tip 12: microchemie deel 5: lood (Pb) aantonen, cerussiet, anglesiet, phosgeniet, ....
een tip van Paul Mestrom
Lood komt in mineralen het meest voor als tweewaardig positief ion: Pb2+.
Veel loodmineralen worden door zuren aangetast. Daarbij komen de lood-ionen in oplossing.
Als zuur kunnen bijvoorbeeld salpeterzuur en zoutzuur gebruikt worden. Cerussiet (PbCO3, een carbonaat!) is geschikt om dit toe te lichten. Breng je een korrel cerussiet in salpeterzuur, dan lost die op onder bruisen:
PbCO3 + 2H3O+ ➞ Pb2+ + CO2 + 3H2O
Wordt zoutzuur gebruikt in plaats van salpeterzuur, dat ziet het er heel anders uit. De hierboven beschreven reactie start wel, maar de vrijkomende lood-ionen reageren met de chloride-ionen uit het zoutzuur:
Pb2+ + 2 Cl- ➞ PbCl2
Het gevormde lood(II)chloride zet zich als een vrijwel afsluitend wit laagje vast op het oppervlak van het cerussiet. Wat je dus ziet is dat er eerst een paar gasbelletjes ontstaan en dat de heldere cerussiet dan een witte coating krijgt.
Van belang is verder dat de concentratie van het zoutzuur niet te laag is. Het lood(II)chloride dat moet ontstaan is namelijk niet echt heel slecht oplosbaar. Bij te lage concentratie zoutzuur (of beter: chloride) ontstaat geen vast lood(II)chloride. Daarom is het ook nu (zoals eigenlijk altijd) van belang ook te testen met bekend materiaal.
Phosgeniet (Pb2CO3Cl2) , dus een carbonaat met ook chloride) reageert met zoutzuur net zo als cerussiet. Met salpeterzuur ziet het er echter anders uit. In eerste instantie begint het mineraal te bruisen, maar na korte tijd wordt het mineraal toch bedekt met lood(II)chloride. Dit ontstaat uit de bij het oplossen vrijkomende lood-ionen en chloride-ionen en wordt afgezet op het oppervlak van het mineraal. Daarmee stopt dan ook de gasvorming. Het oppervlak wordt wit. Onderstaande foto’s illustreren dit:
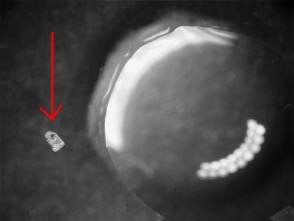
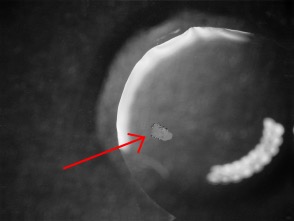
Foto links: 0,6 mm phosgeniet-korrel naast salpeterzuur
Foto rechts: dezelfde korrel in salpeterzuur: op het oppervlak een paar kleine belletjes CO2. Het oppervlak heeft nu een witte coating van PbCl2.
Op deze manier zijn anglesiet, cerussiet en phosgeniet dus vrij gemakkelijk van elkaar te onderscheiden.
Voor de volledigheid: ook anglesiet krijgt in zoutzuur een witte coating van lood(II)chloride. Gasontwikkeling valt hierbij niet waar te nemen, tenzij er een stukje carbonaat-houdende matrix bij het test-stukje zit. Dat laatste zag ik b.v. bij een stukje van Mibladen dat ik onlangs testte. Deze tests bewijzen echter nog niet de aanwezigheid van lood-ionen. Om daar meer zekerheid over te krijgen gebruiken we kaliumjodide (KI). Deze stof lost heel gemakkelijk op en vormt met lood-ionen kleine knalgele zeshoekige blaadjes van lood(II)jodide:
Pb2+ +2I- ➞ PbI2
In het geval van phosgeniet werkt het als volgt:
- breng een druppel salpeterzuur op de zijkant van een microscopeerglaasje op de houder daarvoor
- schuif een kleine korrel phosgeniet (een halve millimeter is groot genoeg) in het salpeterzuur
- neem het glaasje uit de houder en verwarm de kant van de druppel voorzichtig. Ga hiermee door tot alle vocht verdwenen is. Dit is nodig om te zorgen dat er geen salpeterzuur meer overblijft. Dat zou het vervolg storen (zie opmerking 1 aan het eind van dit verhaal)
- laat het glaasje afkoelen in de houder.
- voeg een druppel water toe en laat de vaste stof zo ver mogelijk oplossen (eventueel even “roeren” met een speld, een plastic staafje of iets dergelijks)
- schuif een kleine korrel kaliumjodide in de oplossing
- er ontstaat onmiddellijk geel glinsterend lood(II)jodide
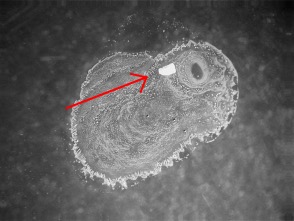
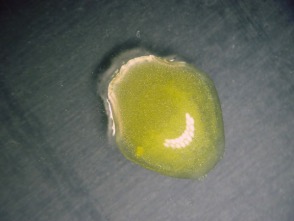
Foto links: de vaste stof die overblijft na indampen. Deze vaste stof bewijst dat een deel van de phosgeniet opgelost is, ook al is de oorspronkelijke korrel met zijn witte coating van PbCl2 nog duidelijk te zien (zie pijl).
Foto rechts: het glinsterende lood(II)jodide na toevoeging van de korrel kaliumjodide.
Opmerkingen:
- Wanneer het salpeterzuur niet verwijderd wordt door indampen zal dit als oxidator reageren met het jodide uit de toe te voegen korrel kaliumjodide. Er ontstaat dan donkerbruin jood ( I2 )
- Overwogen zou kunnen worden azijnzuur te gebruiken in plaats van salpeterzuur omdat loodacetaat (net als loodnitraat) goed oplosbaar is. Azijnzuur is echter een zwak zuur, wat betekent dat er ook als er veel azijnzuur in de oplossing zit de zuurgraad laag is (de pH relatief hoog is).
Om na te gaan of dit zou kunnen werken gebruikte ik kleurloze natuurazijn uit de supermarkt omdat die voor iedereen te verkrijgen is en om het risico van storende nevenreacties zo klein mogelijk te maken. Helaas was het resultaat negatief. Zelfs bij calciet is nauwelijks gasvorming waar te nemen.
Overigens heeft het gebruik van azijn uit de supermarkt nog een paar nadelen. Om te beginnen is het nooit een oplossing met uitsluitend azijnzuur. Er zitten altijd andere stoffen bij die voor storende nevenreacties kunnen zorgen. Dan is er natuurlijk de (in mijn beleving onaangename) geur. Het feit dat je de azijn ruikt betekent ook dat er azijnzuur uit de oplossing ontsnapt en zich gemakkelijk kan hechten aan b.v. je microscoop. Of die dat leuk vind betwijfel ik! Verder is het misschien ook wel goed te weten dat zuiver azijnzuur (ook wel ijsazijn genoemd) tamelijk gevaarlijk is. Op je handen heeft het ongeveer hetzelfde effect als geconcentreerd zwavelzuur (stevige brandwonden!). Het is dus niet verstandig te proberen een hogere concentratie te bereiken door een verdunde oplossing een beetje in te dampen
- Ga je zelf aan de slag, vergeet dan niet de nodige veiligheidsmaatregelen!
